Uma cerveja quente no verão é uma espécie de tragédia sazonal. Mas o fascinante é que a solução não depende de tecnologia sofisticada, mas de princípios físicos tão básicos quanto poderosos. Basta gelo, água, sal… e um pouco de ciência. Neste artigo, vamos explicar, de forma rigorosa mas acessível, por que é que essa garrafa atinge a temperatura ideal em poucos minutos. A chave está numa mudança de fase e num gráfico muito simples.
Este tema já foi abordado num artigo anterior, onde se explicava passo a passo como arrefecer uma cerveja rapidamente usando gelo, água e sal, e se ofereciam instruções práticas para aplicar em situações do dia a dia. No entanto, o objetivo aqui não é repetir esse conteúdo, mas ir um passo além: entender com mais precisão por que funciona. Vamos nos concentrar no mecanismo físico que torna isso possível — a mudança de fase e a transferência de calor — e em como uma representação gráfica simples pode nos ajudar a visualizar todo o processo de forma clara e direta.
A física por trás de uma garrafa gelada: na verdade, o gelo “aquece”
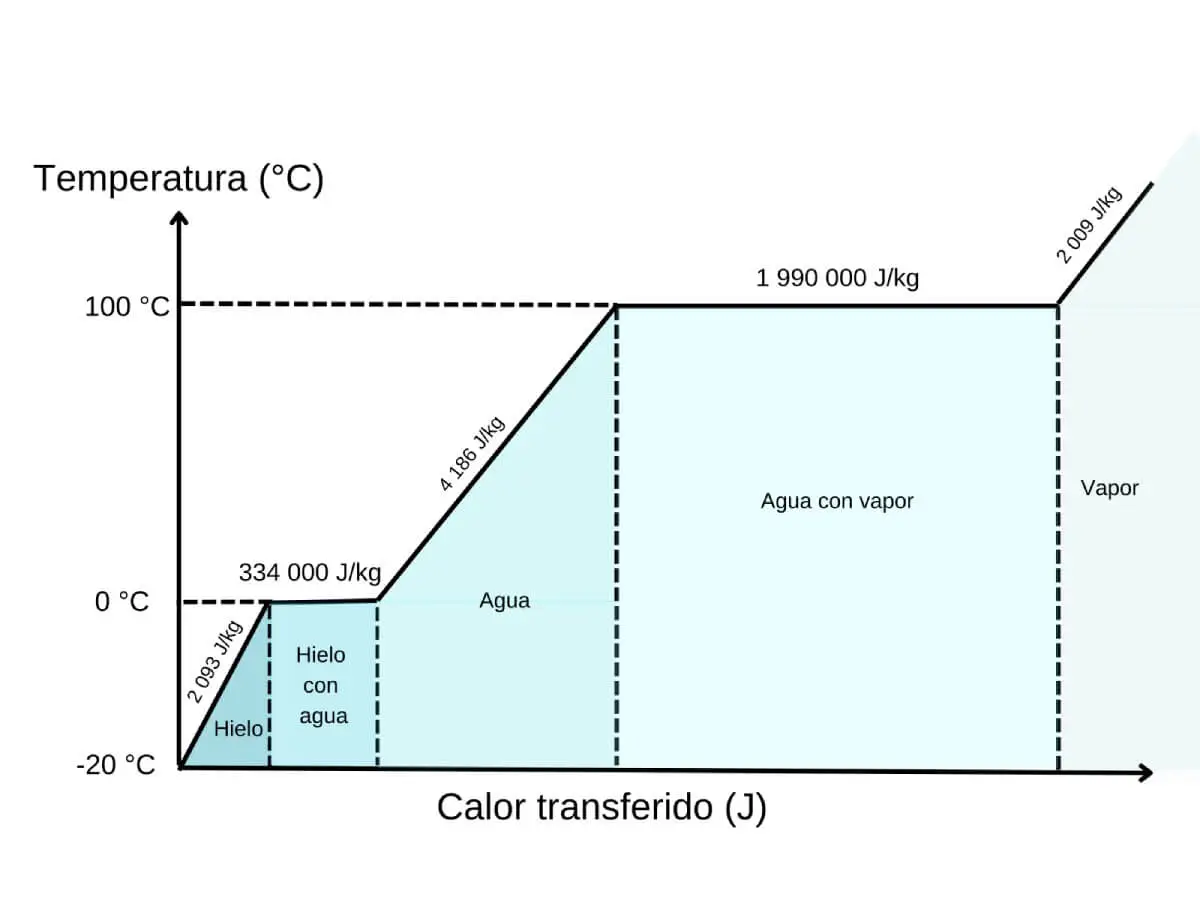
Quando colocamos uma garrafa à temperatura ambiente numa mistura de água, gelo e sal, é ativado um mecanismo de transferência de energia muito eficiente. O protagonista é o gelo, que ao derreter precisa de absorver calor: é o que se conhece como calor latente de fusão. O interessante é que, durante esse processo, a temperatura do gelo não aumenta. Toda a energia absorvida é investida exclusivamente em quebrar as estruturas cristalinas do gelo para transformá-lo em água líquida.
Esse calor necessário para derreter o gelo não aparece do nada. Ele vem do ambiente imediato, ou seja, da água que o rodeia e das garrafas de cerveja. Na prática, o gelo «rouba» calor da cerveja, o que provoca uma rápida diminuição da sua temperatura.
O papel do sal: manipular o ponto de congelamento
Adicionar sal à mistura altera um segundo fenómeno físico fundamental: a descida crioscópica. Ao incorporar sal, o ponto de congelamento da água desce abaixo dos 0 °C. Isto obriga o sistema a atingir temperaturas mais baixas antes que o gelo possa parar de derreter. Em alguns casos, a mistura pode estabilizar-se em torno dos –10 °C.
Isso amplifica a diferença de temperatura entre a cerveja e o meio em que está imersa, fazendo com que o calor flua ainda mais rapidamente do interior da garrafa para o exterior.

Um gráfico (qualitativo) que explica tudo
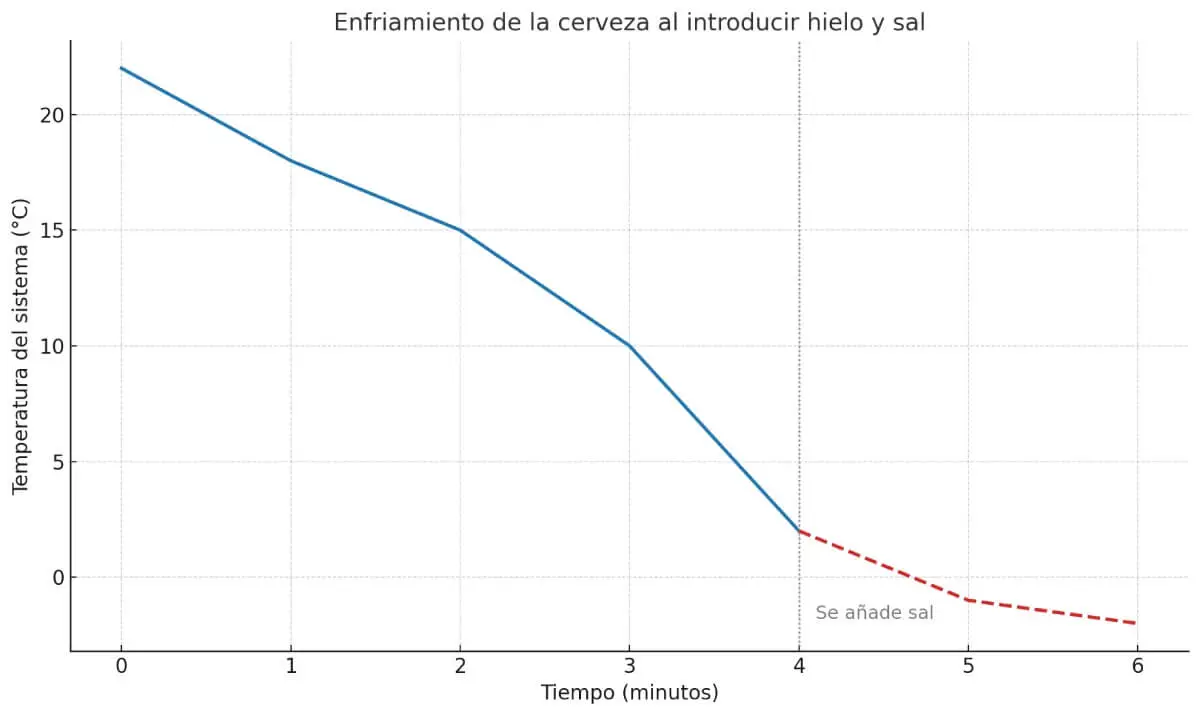
Se representássemos a temperatura do sistema em função do tempo, observaríamos uma primeira queda moderada ao introduzir o gelo na água. Mas ao adicionar sal, o arrefecimento continua abaixo de 0 ºC, ao contrário do que nos diz a intuição. O gráfico mostraria como se passa de um arrefecimento progressivo que parece que vai parar em 0 ºC para um arrefecimento contínuo, exatamente no momento em que o sistema entra na faixa de temperaturas abaixo de zero.
Esta mudança de inclinação reflete a eficiência térmica do sistema: quanto maior o gradiente de temperatura entre a cerveja e o seu ambiente, maior a velocidade de transferência de calor. E se o ambiente estiver abaixo do ponto de congelamento da água, o efeito é ainda mais contundente.
A água como condutor térmico
Outro fator crucial no processo é a água. Embora possa parecer que ela arrefece menos do que o gelo, a sua presença é indispensável. Por ser um líquido, a água adapta-se perfeitamente à forma das garrafas, preenchendo todos os espaços. Isso garante um contacto constante e uniforme entre o meio frio e a superfície da garrafa, maximizando a transferência de calor por condução.
Este efeito é ainda mais potenciado se for utilizado gelo picado, uma vez que a sua maior superfície de contacto permite uma transferência térmica mais eficiente. Cada pequeno pedaço de gelo atua como um canal de absorção de calor, muito mais eficaz do que os cubos grandes, que deixam espaços vazios entre as garrafas.
Então… qual é a curva?: o patamar do frio!
É a que representa como o gelo, ao receber calor, não muda de temperatura instantaneamente, mas permanece a 0 °C enquanto derrete. Essa linha horizontal, essa pausa na queda da temperatura, é a chave: mesmo que o ambiente continue a arrefecer, o gelo precisa de absorver energia para quebrar a sua estrutura sólida e se transformar em água. A curva não mostra apenas uma descida: mostra uma transformação. E nesse patamar está o coração do processo.









